Je suis particulièrement fier de cet article car c’est mon premier article. Tout étudiant en thèse aura connu ce sentiment de nullité qui l’accapare quand il constate avec horreur que deux, voire trois ans de thèse se sont écoulés et qu’il n’a toujours rien publié. Le sentiment s’était cristallisé dans mon cas en un véritable complexe : je ne suis pas au standard, je n’ai pas la Rigueur, et patati patata. C’est donc avec un soulagement immense que la plupart des thésards accueillent la nouvelle de la publication de leur premier article, et je n’y fis pas exception: c’est un peu l’équivalent d’un dépucelage en matière de science.
Le titre initial de l’article était quelque chose du genre » saponification 2D en AFM liquide », ce qui nous avait valut une première salve de critiques virulentes, « quels savons ? « , « l’AFM n’est pas un liquide voyons » etc. mais c’est avec plaisir que je récupère ce titre qui me plaisait bien au profit de ce billet.
Eugène Chevreul, que voici, découvrit la réaction de base de la saponification que nous apprenons au lycée et qui consiste à mélanger de la graisse animale à une substance alcaline, de la soude par exemple.
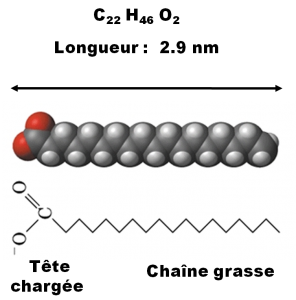
La graisse animale contient des acide gras, de longues chaînes de carbone, assemblées sous forme de triglycérides (trois chaînes nouées à un bout): la réaction de saponification va conduire à la dissociation du triglycéride et la formation d’un sel d’acide gras, qui ressemble à ça :
Dans cette étude, nous considérons la toute dernière étape de la réaction de saponification, quand le triglycéride est déjà dissocié. La situation de départ de notre réaction chimique est épurée au possible pour simplifier l’observation, nous partons d’un film d’épaisseur monomoléculaire – on parle d’une monocouche – de l’acide gras en question. On l’obtient par le procédé dit de Langmuir-Blodgett, qui consiste à déposer d’abord la molécule d’intérêt à la surface de l’eau, puis à faire traverser la surface par l’objet à recouvrir. C’est un peu comme l’huile d’olive qu’on rajoute dans l’eau de cuisson des pâtes : elle se dépose au moment où la nouille traverse l’interface. Pour ses travaux sur les nouilles, euh sur les films monomoléculaires, Langmuir a reçu le prix Nobel de chimie en 1932 et donné son nom à la revue dans laquelle nous avons publié les observations que je suis sur le point de vous relater.
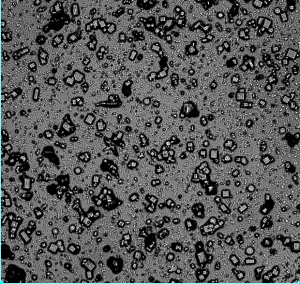
Nous partons donc d’une couche monomoléculaire dans l’eau que nous observons à l’aide d’un instrument formidable que j’évoquerai dans un prochain billet, le microscope à force atomique (AFM). Pas un ion dans les parages. A l’instant t0, j’ajoute de la soude, et voici ce qui arrivait sous mes yeux écarquillés, un mercredi soir vers 20H au Commissariat à l’Energie Atomique:
Des îles. Je distinguais même après quelques heures un chien St Bernard :
Nous fûmes fort intrigués. La soude déprotonait les acides gras, c’est à dire décapsulait l’atome d’hydrogène pour y laisser un électron, une charge. Mais pourquoi charger le film, et donc augmenter la répulsion électrique entre acide gras voisins conduisait-il à l’apparition de plaques condensées ?
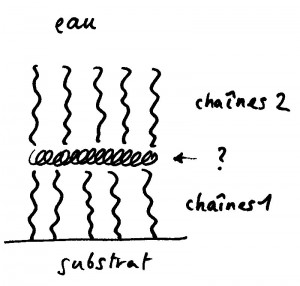
Le travail minutieux d’analyse auquel nous nous livrèrent égrena les indices un à un: les plaques avaient l’épaisseur de deux couches, ni plus ni moins; au terme de la réaction les plaques occupaient exactement la moitié de la surface du substrat. A l’évidence, une moitié de notre couche se rabattait sur l’autre, comme une crêpe. L’expérience marchait en utilisant en lieu et place du sodium Na+ le potassium K+, le Lithium Li+, mais était inhibée par les ions divalents comme le calcium Ca2+. Les plaques étaient de nature hydrophobe, c’est à dire qu’elles exposaient leur partie grasse à l’eau. L’arrangement des molécules dans la couche devait être quelque chose comme ça :
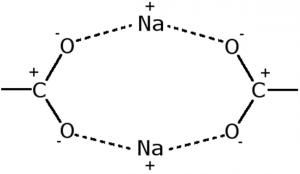
et il n’était pas très clair quelle était la marmelade au milieu, ni pourquoi la partie grasse de la monocouche se détachait de son substrat (gras) pour aller exposer sa graisse à l’eau, ce qui semblait en tout point contraire à l’idée forte et juste que l’eau n’aime pas la graisse. La clé du mystère, comme nous le découvrirent plus tard, résidait dans la nature de la marmelade, la voici :
Les ions sodium dans cet arrangement réalisent un anneau parfait de huits charges de signes alternés formant un lien très fort, on parle de pontage coulombique, où le nom de M. Coulomb se réfère à la nature électrostatique de l’arrangement atomique. Cette organisation est assez rare dans la nature et ne se trouve que dans des situations très alkalines, où les densités d’ions sodium sont fortes et les têtes chargées. Le pontage coulombique est généralement plutôt réalisé par des ions à deux (ou plus) charges, comme le calcium. On peut par exemple ponter des fibres entre elles avec des ions multivalents : l’accroche très forte permet au matériau ainsi constitué de résister à des contraintes mécaniques importantes.
Un aspect conceptuel intéressant de ce travail est le suivant : considérons les deux moitiés de la monocouche (celles qui se sont rabattues) disposées non-pas sur le même substrat mais en vis-à-vis. On a alors deux surfaces chargées négativement, qui se repoussent donc. C’est par cette stratégie de charge que l’on maintient des suspensions de particules à l’état dispersé (et non floculé – comme les vieux pots de peinture). Approchons les : à un certain moment, elles doivent s’attirer, cristalliser et former des plaques. Des plaques de savon.